سدیم دودسیل سولفات (SDS) که سدیم لوریل سولفات هم نامیده می شود یک دترجنت آنیونی است که بدلیل خاصیت ضدعفونی کنندگی، کاربرد های فراوانی در محصولات شوینده، بهداشتی و آزمایشگاهی دارد. سدیم لوریل سولفات قابلیت نفوذ زیادی به دیواره سلولی و غشا پلاسمایی میکروارگانسیم ها از طریق اتصال به چربی ها و پروتئین ها و دناتوره کردن ساختار پروتئین ها دارد. از این ماده در آزمایشگاه برای تخریب ساختار دو و سه بعدی پروتئین ها و استخراج اسید های نوکلئیک از جمله DNA و RNA استفاده می شود. برای بررسی بیشتر تا پایان صفحه با ما همراه باشید.
محصولات مرتبط
سدیم دودسیل سولفات (SDS) چیست؟
سدیم لوریل سولفات یا به اختصار SLS یک سورفکتانت آنیونی قوی با فرمول شیمیایی C12H25NaO4S و جرم مولکولی 288.38g/mol می باشد. این ماده با دارا بودن یون سدیم و سولفات، جز ترکیبات یونی به حساب میآید. SDS یکی از فعال ترین مواد فعال سطحی آنیونی و از پاک کنده های سنتزی قوی است که در آزمایشگاه ها از آن استفاده میشود. این ماده محرک پوست است و میتواند مولکول ها و پروتئین های پوست را تخریب نمایید. لذا در هنگام کار با این ماده باید نکات ایمنی رعایت گردد.
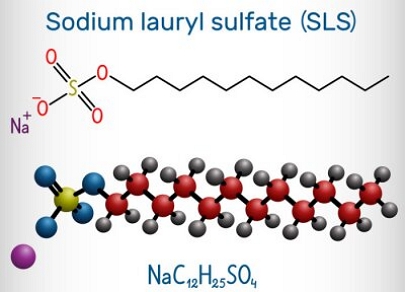
خواص فیزیکی و شیمیایی:
| نام دیگر | سدیم لوریل سولفات |
| فرمول شیمیایی | C12H25NaO4S |
| وزن مولکولی | 288.38 گرم بر مول |
| مشخصات ظاهری | جامد کریستالی سفید رنگ |
| نقطه جوش | 216 درجه سانتی گراد |
| نقطه ذوب | 205 درجه سانتی گراد |
| PH | pH(10 g/l H2O, 20 ºC) 6 - 9,0 |
| دانسیته | 0.63 g/cm3 |
| دمای نگهداری | Store between 15ºC and 25ºC |
| علائم هشداردهنده |  |
کاربرد سدیم دودسیل سولفات چیست؟
- به عنوان یک دترجنت آنیونی قوی در مواد شوینده برای پاک کردن لکه های چربی استفاده می شود.
- به دلیل دارا بودن قابلیت کف کنندگی در تولید صابون، خمیر دندان و شامپو استفاده می شود.
- برای واسرشت کردن ساختمان پروتئین ها استفاده می شود.
- SDS قابلیت ضدعفونی کردن بالایی دارید و یک میکروی کش قوی می باشد.
- در مولکولار بیولوژی برای دناتوره کردن پروتئین ها، برای استخراج اسیدهای نوکلئیک از قبیل DNA و RNA، برای ساخت SDS-PAGE ( الکتروفورز ژل پلی آکریل آمید دودسیل سولفات سدیم) استفاده می شود.
نکات ایمنی و مضرات سدیم دودسیل سولفات
- در تماس با پوست سمی است.
- باعث آسیب جدی به چشم می شود.
- جامد قابل اشتعال.
- در صورت بلعیدن مضر است.
- در صورت استنشاق مضر است.
- باعث تحریک پوست می شود.
- ممکن است باعث تحریک تنفسی شود.
- مضر برای آبزیان با اثرات طولانی مدت.

انواع ژل های پلی اکریل آمید
در سال ۱۹۵۹، ری موند و وین تراب استفاده از اکریل آمید متصل شده با بیس اکریل آمید را برای تشکیل یک قالب ژل گزارش کردند. دو سال بعد در سال ۱۹۶۱ دیویس این پلیمر را در لوله ها بکار برد. پلی اکریل آمید نسبت به سایر ژل ها، انعطاف پذیرتر و قویتر بوده و ساخت آسان تری دارد. هم چنین نسبت به تابش های مرئی و فرابنفش شفاف است. الکترواسمز آن ناچیز است و طیف وسیعی از بافرها با آن میتوانند بکار روند از سوی دیگر پلی اکریل آمید یک پلیمر غیر یونی است که از نظر شیمیایی کاملا بی اثر بوده و نسبت به گرما پایدار است. همه این ویژگی ها باعث می شود که زمان اجرای الکتروفورز کوتاه تر شود. با افزایش غلظت پلی اکریل آمید اندازه متوسط خلل و روزنه کاهش می یابد. در نتیجه با تغییر غلظت میتوان غربالگری ژل را کنترل کرد. اندازه خلل و روزنه این ژل ها از حدود 2nm برای ۳۰ گرم اکریل امید 100ml تا 5nm برای ۷/۵ گرم اکریل امید در 100ml متغیر است. کاتالیزگرهای مورد استفاده آمونیوم پرسولفات یا پتاسیم پرسولفات و تمد (تترا متیل اتیلن دی آمید، TEMED) هستند.
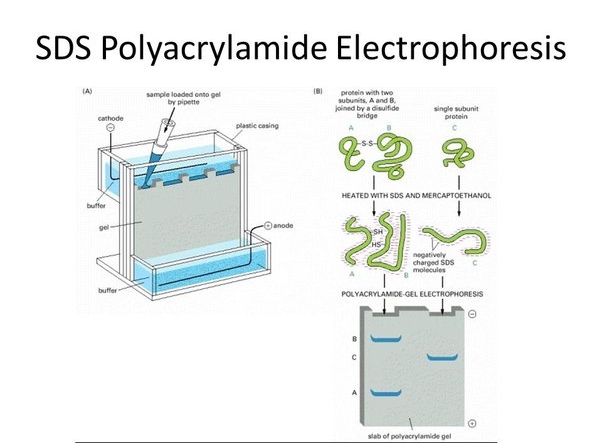
کاربرد سدیم دودسیل سولفات در ساخت ژل پلی آکریل آمید SDS-PAGE
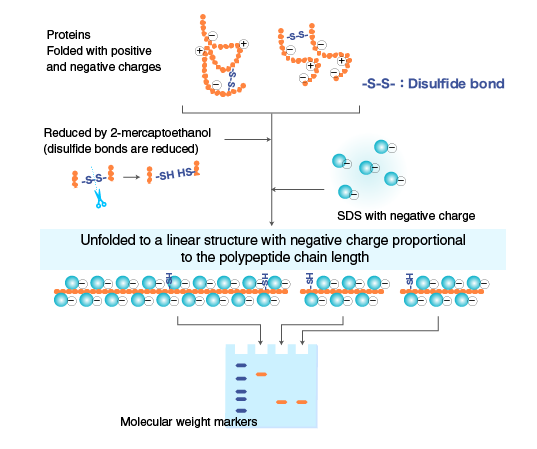
استفاده از سدیم دو دسیل سولفات (SDS) در الکتروفورز توسط شاپیرو و همکارانش در سال ۱۹۶۷ معرفی شد که در آن جداسازی بر اساس وزن مولکولی انجام می گیرد. از SDS برای جداسازی ترکیبات خنثی یا محلول با وزن مولکولی بالا مانند پروتئین ها استفاده می شود. با توجه به نوع مولکول های موجود و درجه پلیمری شدن حد واسط الکتروفورزی، چگونگی عملکرد سدیم دو دسیل سولفات متفاوت است. برای سیستم های با تخلخل کم و یا مایعات، محلول آبی و رقیق یک شوینده قطبی مانند سدیم دو دسیل سولفات به صورت مولکول های مجزا وجود دارد اما با افزایش غلظت مولکولها در کنار هم تجمع یافته و مایسل را تشکیل می دهند. حال اگر مولکول های خنثی به درون این مایسل ها وارد شوند می توانند جدا شوند. مایسل ها دارای بار منفی بوده و با حرکت به سمت آند، ذرات خنثی به دام افتاده در درون خود را نیز حمل می کنند. به عبارت دیگر زمانی که پروتئین ها درون مایسل ها به دام می افتند همگی دارای بار منفی می شوند و تنها از نظر اندازه با هم متفاوت هستند. بنابراین با توجه به بار و تحرک الکتروفورزی یکسان، حمل می شوند و برای جداسازی تنها لازم است که مواد در ژلی با اندازه حفره کوچک قرار گرفته و بر اساس وزن مولکولی از هم جدا شوند. پروتئین ها و پلی پپتیدها از اسیدهای آمینه تشکیل شده اند و طوری پیچ خورده اند که یک ساختار ۳ بعدی را ایجاد میکنند وجود SDS و حضور یک عامل کاهنده باعث می شود که زنجیره ی پلی پپتیدی باز شده و یک ساختار میله مانند ایجاد شود که هسته پلی پپتیدی بوسیله مولکول های SDS پوشانده می شود.
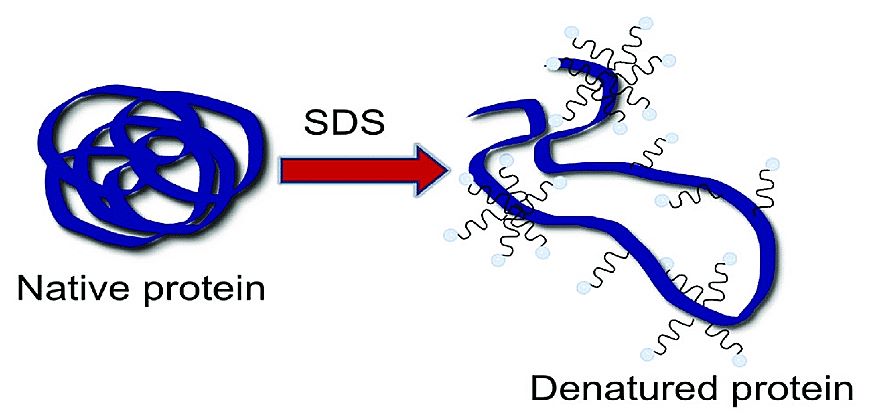
در واقع می توان گفت پیوندهای S-S مولکول های پروتئین در حضور یک عامل کاهنده مانند 2- مرکاپتو اتانول ۱% شکسته شده و گروههای SH تشکیل می گردد. این امر منجر به بهم خوردن ساختارهای دوم، سوم و چهارم پروتئین شده و تولید زنجیرهای پلی پپتیدی میله مانند می کند. در حضور یک ماده فعال سطحی مانند SDS قسمت غیر قطبی ماده فعال سطحی به قسمت آب گریز پروتئین متصل می شود. به دلیل زیاد بودن تعداد مولکولهای SDS پیوند شده بار پروتئین پوشانده می شود و همه مولکولهای پروتئین ضرورتا دارای بار منفی خواهند بود در واقع SDS با گروه های SH پروتئین ها پیوند می دهد این حالت باعث می شود که تفاوت موجود در بارهای مولکولی پروتئینی با بار متفاوت در حضور SDS از بین برود. پروتئین های دارای وزن مولکولی زیاد نسبت به مولکول های با وزن مولکولی کمتر، بیشتر به SDS پیوند می شوند و از آنجایی که مولکول SDS یک بار خالص منفی در pH خنثی دارد بنابراین SDS پلی پیتیدهای بزرگتر بار منفی بیشتری خواهند داشت در pH خنثی وجود ۱ درصد وزنی SDS و 1 مولار 2-مرکاپتو اتانول به عنوان عامل کاهنده قادر است که بیشتر پروتئین ها را به زنجیرهای پلی پپتیدی بشکند زیرا مرکاپتواتانول پل های دی سولفیدی را شکسته و SDS بر اساس واکنشهای آب گریزی به زنجیرهای پلی پپتیدی پیوند می شود. شکل زیر تغییر ماهیت یک پروتئین کروی را بوسیله ۱ درصد وزنی SDS در حضور B مرکاپتو اتانول نشان می دهد زنجیر پلی پیتیدی پیچ خورده باز شده و یک ساختار میله ای تشکیل می شود که پلی پیتید در مرکز قرار گرفته و با مولکول های SDS دارای بار منفی پوشانده شده است. برای غیر فعال کردن آنزیم هایی که باعث تداخل و مزاحمت در نتیجه هستند در ابتدای کار به مدت دو دقیقه پروتئین در دمای ۱۰۰ حرارت داده می شود.

نسبت بار به اندازه پروتئین هایی که به این روش الکتروفورز می شوند ثابت است زیرا SDS متصل شده به هر واحد پروتیین مقدار ثابتی است (1.4 گرم SDS به ازای هر گرم پروتئین). به همین دلیل کمپلکس های SDS-پلی پپتید با سرعتی که تنها به اندازه آنها بستگی دارد مهاجرت می کنند و جداسازی پروتئین ها در الکتروفورز تحت چنین شرایطی تقریبا بطور کامل به تفاوت در وزن مولکولی آنها وابسته است. اما سوال این جاست که چرا با وجودی که مولکولهای بزرگتر بار بیشتری دارند اما مولکول های کوچکتر سریعتر مهاجرت می کنند؟ علت این امر اثر غربالی ژل است. دو محدوده (حد) وجود دارد: برای ژل پلی اکریل آمید ۱۰ درصد محدوده جداسازی خطی نرمال، پروتئین هایی با وزن مولکولی ۷۰٠٠٠ - ۱۵۰۰۰ است. مولکول های بزرگتر نمی توانند از حفره ها عبور کرده و در نتیجه مهاجرت نمی کنند. در حالی که مولکول های کوچک از حفره ها عبور کرده و با هم مهاجرت می کنند. یک ژل ۱۵ درصد وزن مولکولی تا ۶۰۰۰ را جدا می کند. وزن های مولکولی بالاتر تا ۲۰۰۰۰۰ هم می توانند جدا شوند اما منحنی S شکل می شود. با استفاده از استانداردها می توان وزن مولکولی یک ماده نامشخص را در شرایط مناسب با ۲ درصد خطا بدست آورد. برای جداسازی پروتئین های اسیدی می توان از شوینده های کاتیونی مانند تترا متیل آمونیوم برمید، هگزیل پیریدینیوم کلرید و ستیل تری متیل آمونیوم برمید استفاده کرد. برای کمک به حفظ ساختار پروتئین و هم چنین آسان تر شدن فرایند جداسازی SDS در پایان کار، از اوره ۶ مولار استفاده می شود. هر چند که میتوان SDS را به کمک کیسه دیالیز نیز جدا نمود اما این روش علاوه بر زمان بر بودن میتواند باعث تغییر ساختاری اولیه پروتئین ها نیز شود. در ژل های SDS-PAGE میزان تحرک پروتئین های کربوکسی متیل دار شده به طور معکوس متناسب با لگاریتم وزن مولکولی است. اگر حفره های غربال به صورت کره های کامل با قطر متفاوت در نظر گرفته شود. بنابراین یک مولکول با توجه به مساحت سطح مقطع حفره که متناسب با مربع قطر کره است عبور می کند. از آن جایی که وزن مولکولی متناسب با حجم و در نتیجه متناظر با مکعب قطر کره است، پس لگاریتم وزن مولکولی نسبت به تحرک الکتروفورزی خطی خواهد بود.
برخی پروتئین ها در SDS-PAGE رفتاری غیر عادی دارند به خصوص برخی گلیکو پروتئین ها به میزان عادی به SDS متصل نمی شوند (1.4 گرم SDS به ازای هر یک گرم پروتئین). در نتیجه نسبت بار الکتریکی به وزن مولکولی در آن ها مشابه این نسبت در پروتئین های دیگر نیست و مهاجرت آن ها کمتر بوده و به همین دلیل وزن مولکولی بیشتری از خود نشان می دهند. پروتئین هایی با بار منفی زیاد و یا بار مثبت زیاد مثل هیستون ها و یا پروتئین های غنی از پرولین مثل کلاژن در مجاورت SDS به طور غیر طبیعی وزن مولکولی بالایی از خود نشان میدهند. بطور کلی میتوان گفت که SDS-PAGE در جداسازی پروتئین هایی با وزن مولکولی خیلی مشابه که بعد از متیل دار شدن یا استیل دار شدن متفاوت می شوند از ارزش اندکی برخوردار است. برای آنالیز این پروتئین های تغییر یافته از روش PAGE با اوریک اسید استفاده می شود که در آن هم وزن مولکولی و هم بار پروتئین در فرایند جداسازی دخالت دارد. پروتئین در pH اسیدی بار مثبت دارد و در میدان الکتریکی به سمت کاتد حرکت می کند به این دلیل از روش PAGE - اوریک اسید برای جداسازی پروتئین هایی با اندازه یکسان و بار متفاوت بکار می رود.
مزایای عملی الکتروفورز SDS
- SDS تقریبا با تمام پروتیین ها واکنش می دهد.
- چون کمپلکس های SDS-پروتئین به شدت باردار شده اند تحرک الکتروفورزی افزایش می یابد.
- چون تمام اجزا به صورت یکنواخت باردار شدهاند (علامت بار آنها یکسان است) همگی در یک جهت حرکت می کنند.
- میزان تفکیک بسیار بالاست.
- جداسازی بر اساس یک پارامتر شیمی-فیزیکی یعنی وزن مولکولی است و این یک روش آسان برای تعیین وزن مولکولی است.
- استقرار (تثبیت) نوارها آسان است.
- بعد از انتقال الکتروفورز بر روی غشای تثبیت شده، SDS می تواند بدون از دست رفتن پروتئین ها جدا شود.
- پروتئین ها با SDS پیوند شده به رنگینه بهتر جدا می شوند. حد تشخیص این روش در مقایسه با PAGE خنثی ۱۰ برابر بیشتر می باشد.












دیدگاه خود را بنویسید